 国内第Ⅲ相試験(MOVEST:ボンビバ静注を対照とした非劣性試験)
国内第Ⅲ相試験(MOVEST:ボンビバ静注を対照とした非劣性試験)
MOVEST:Monthly Oral VErsus intravenouS ibandronaTe
 骨密度増加効果
骨密度増加効果
① 腰椎(L2-L4)骨密度 [ 主要評価項目 ]
主要評価項目である12ヵ月目における腰椎(L2-L4)骨密度のベースラインからの変化率の最小二乗平均値(95%信頼区間)※1は、ボンビバ経口群で5.17%(4.64~5.69%)、ボンビバ静注群で5.40%(4.88~5.91%)でした。両群の変化率の差(95%信頼区間)は
-0.23%(-0.97~0.51%)であり、ボンビバ経口群のボンビバ静注群に対する非劣性が検証されました(非劣性限界値-1.6%※2)。
●腰椎(L2-L4)骨密度のベースラインからの変化率
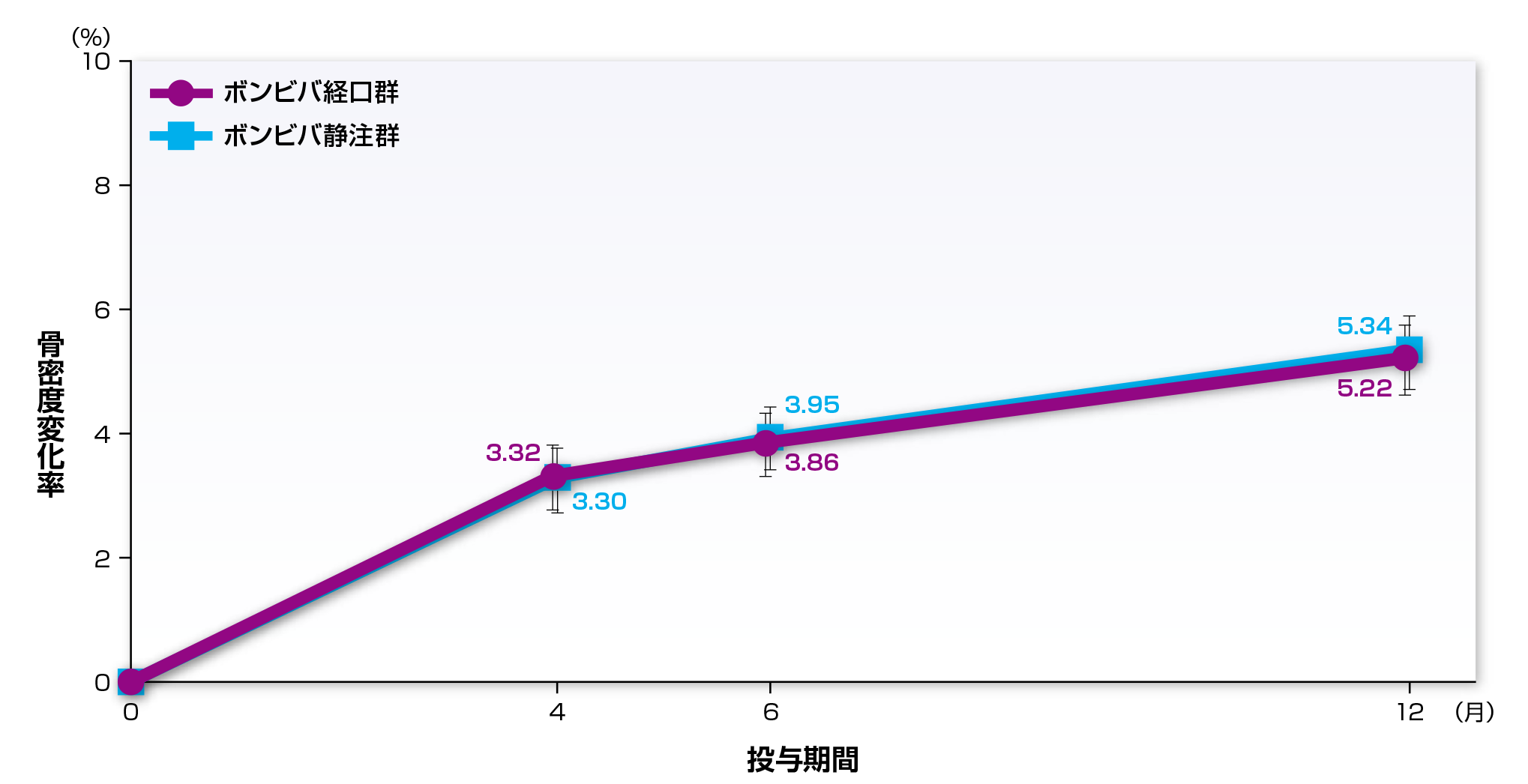
平均値±95%信頼区間
LOCF(Last Observation Carried Forward):欠測値に関してその直前値で補完する方法
| 患者数 | ベースライン | 4ヵ月 | 6ヵ月 | 12ヵ月 |
|---|---|---|---|---|
| ボンビバ経口群 | 183 | 183 | 183 | 183 |
| ボンビバ静注群 | 189 | 189 | 189 | 189 |
●12ヵ月目の腰椎(L2-L4)骨密度変化率の差(PPS)
| 最小二乗平均値 | 95%信頼区間 | |
|---|---|---|
| 経口群-静注群 | -0.23 | -0.97~0.51 |
| 経口群 | 5.17 | 4.64~5.69 |
| 静注群 | 5.40 | 4.88~5.91 |
対照薬であるボンビバ静注の第Ⅱ/Ⅲ相試験におけるPPSのうち、本試験の選択基準を考慮して調整を行った対象集団(Modified PPS)において、ボンビバ静注群の12ヵ月目の腰椎(L2-L4)骨密度変化率(平均値±S.D.)は、5.53±4.46%であった。また、プラセボでの12ヵ月目の腰椎骨密度変化率を、類薬であるミノドロン酸水和物の後期第Ⅱ相臨床試験※3を参考に0.72%と推測した。
以上から、対照群の腰椎(L2-L4)骨密度変化率のプラセボ群との差を4.81%と推定し、この差の1/3以下の値である1.6%を非劣性マージンとして設定した。国内第Ⅲ相試験では、1年目の腰椎(L2-L4)骨密度変化率の差(ボンビバ経口群-ボンビバ静注群)の95%信頼区間の下限が非劣性限界値(-1.6%)を上回れば、非劣性が成り立つとした。
※3:医薬品医療機器総合機構ホームページ. リカルボン錠1mg, ボノテオ錠1mgの審査報告書(2008年10月8日付). http://www.pmda.go.jp/
② 大腿骨骨密度 [ 副次評価項目 ]
副次評価項目である12ヵ月目における大腿骨骨密度のベースラインからの変化率の平均値(95%信頼区間)は、近位部ではボンビバ経口群およびボンビバ静注群でそれぞれ2.41%(1.95~2.87%)および2.76%(2.33~3.19%)、頚部ではそれぞれ2.58%(1.87~3.29%)および2.64%(2.06~3.23%)でした。
 大腿骨近位部骨密度のベースラインからの変化率
大腿骨近位部骨密度のベースラインからの変化率
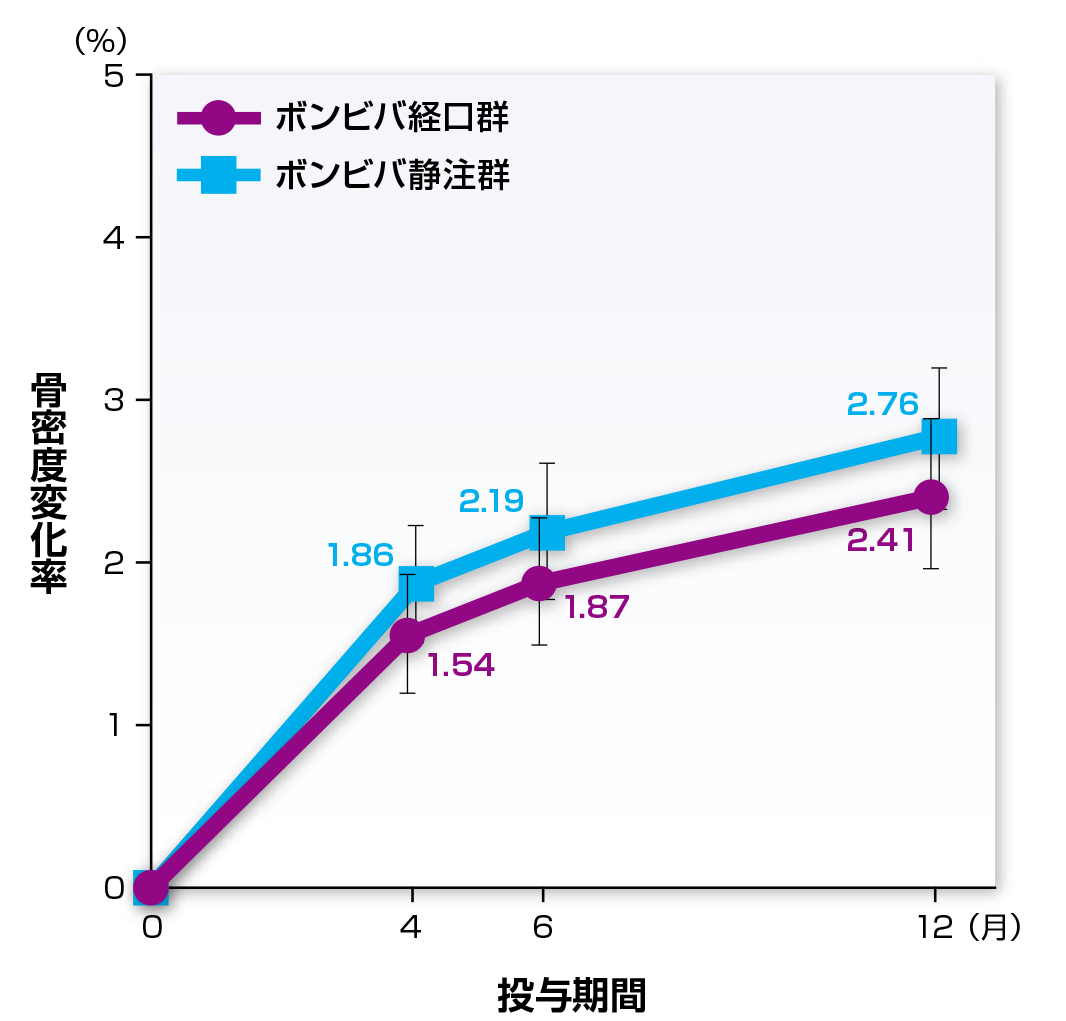
PPS
平均値±95%信頼区間
LOCF(Last Observation Carried Forward):
欠測値に関してその直前値で補完する方法
| 患者数 | ベースライン | 4ヵ月 | 6ヵ月 | 12ヵ月 |
|---|---|---|---|---|
| ボンビバ経口群 | 183 | 180 | 181 | 181 |
| ボンビバ静注群 | 189 | 188 | 189 | 189 |
 大腿骨頚部骨密度のベースラインからの変化率
大腿骨頚部骨密度のベースラインからの変化率
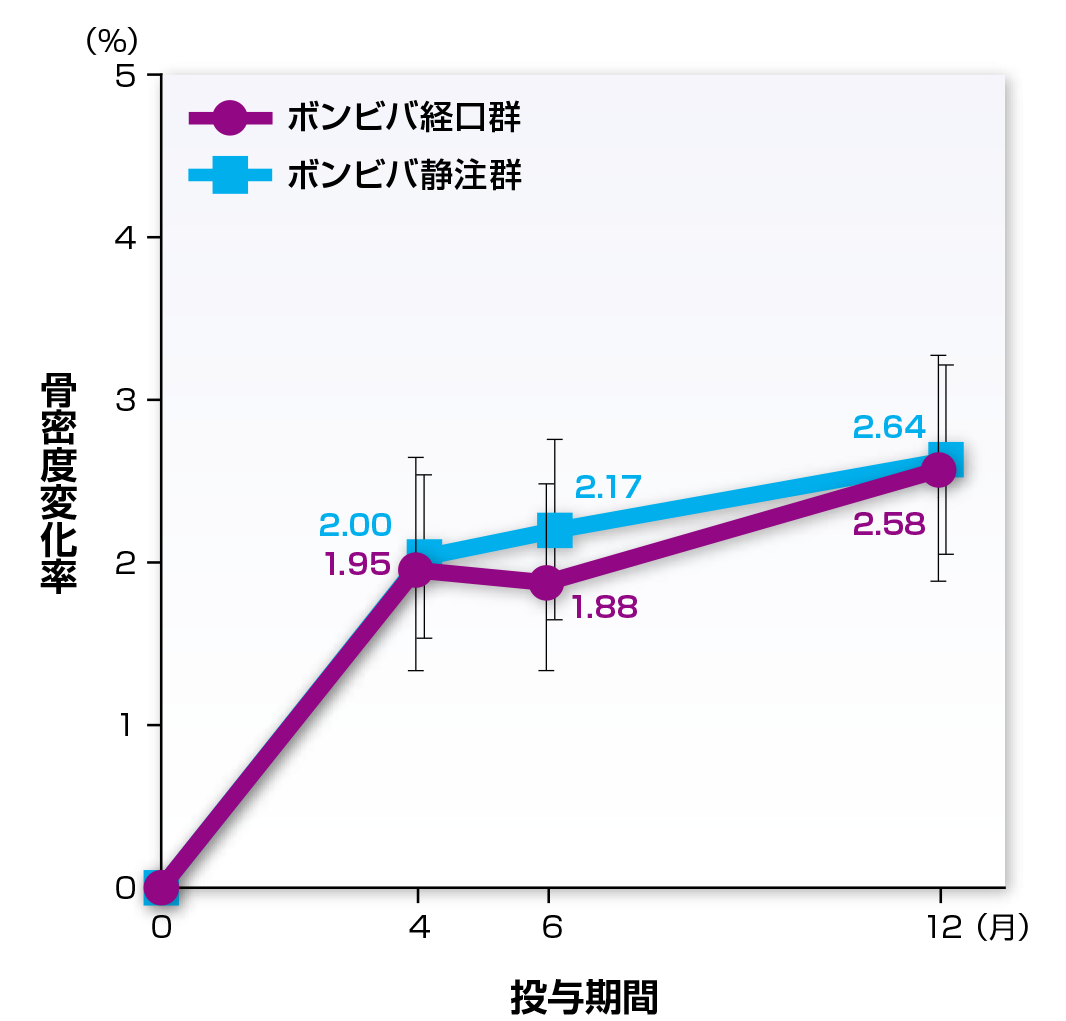
| 患者数 | ベースライン | 4ヵ月 | 6ヵ月 | 12ヵ月 |
|---|---|---|---|---|
| ボンビバ経口群 | 183 | 180 | 181 | 181 |
| ボンビバ静注群 | 189 | 188 | 189 | 189 |







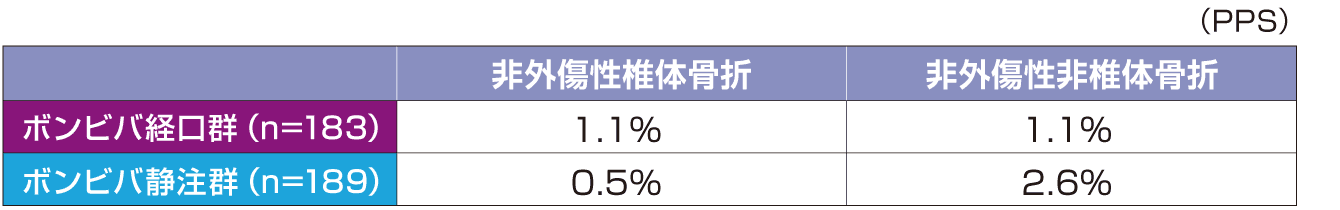
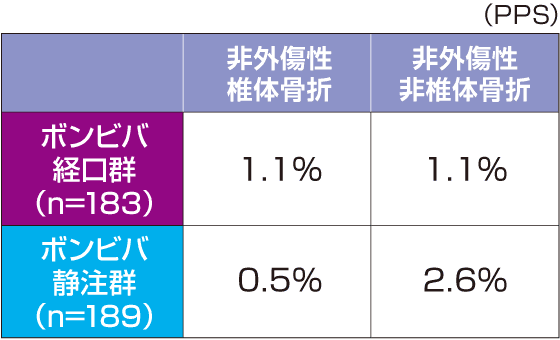

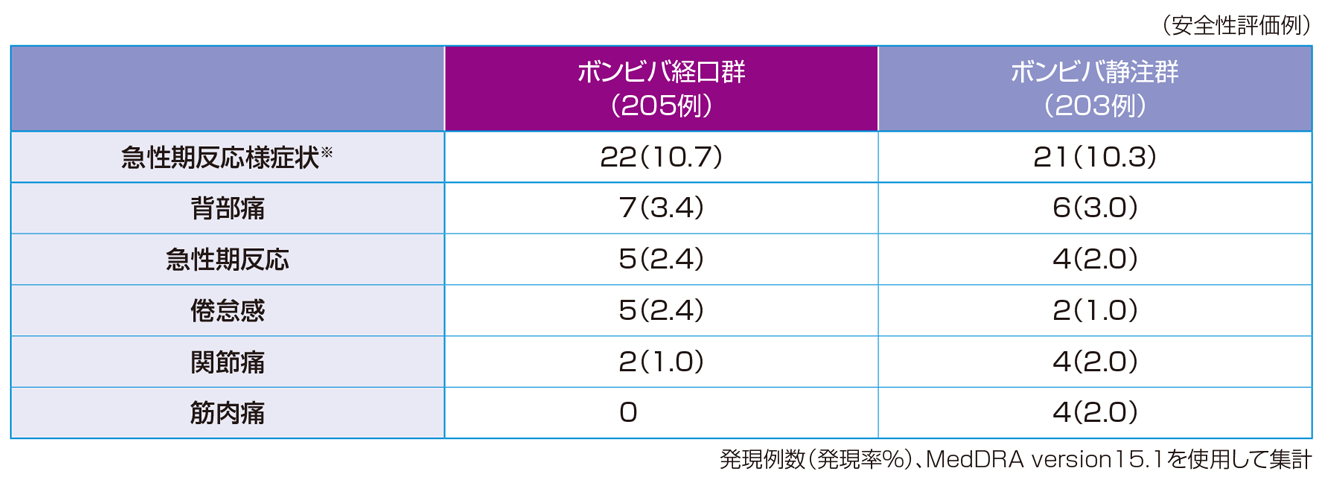
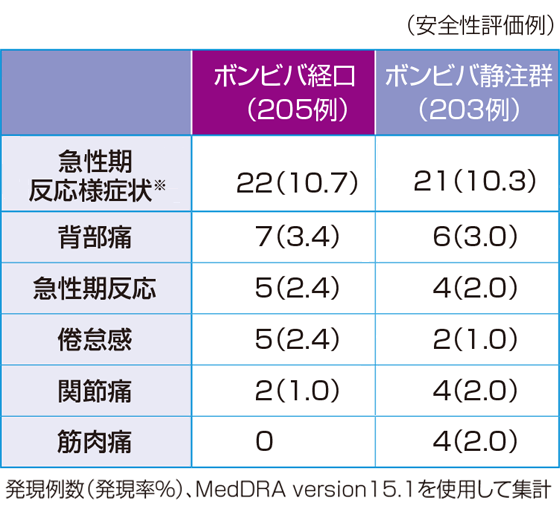
※1:投与群を主効果とし、ベースラインの腰椎(L2-L4)骨密度、P1NP値(自然対数変換値)および腰椎(L2-L4)骨密度とビスホスホネート製剤による前治療の有無とビスホスホネート製剤以外の骨粗鬆症治療薬による前治療の有無の交互作用を共変量とした共分散分析による推定値