第Ⅲ相臨床試験(フルルビプロフェンパップとの比較試験[検証試験])
起立時の膝の痛みに対する鎮痛効果[主要評価項目]
ロコアテープ群はフルルビプロフェンパップ群に対してVAS変化量(終了時)において優越性が検証されました。
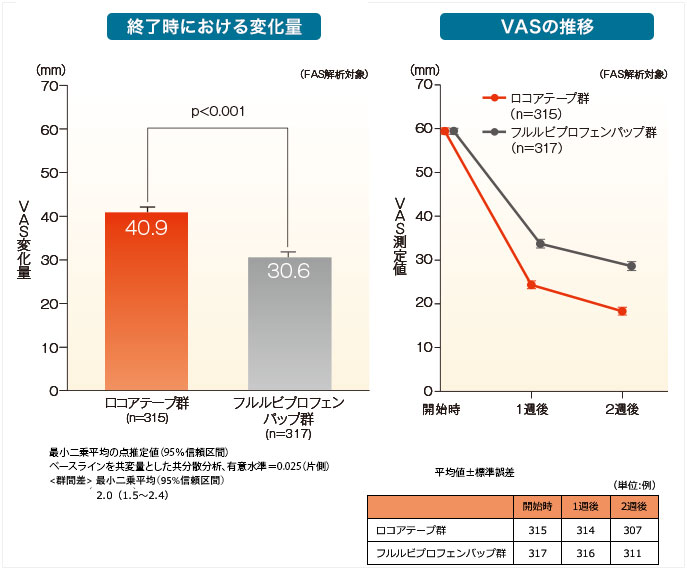
【VAS(起立時の膝の痛み)の評価・測定方法】椅子から立ち上がる時の膝の痛みを、患者がVASで評価した。欠測値について、各評価時期は集計から除外、終了時はLOCF(Last Observation Carried Forward)法を用いて入力した。
承認時評価資料(変形性膝関節症患者を対象とした第Ⅲ相試験)
Yataba I et al. Mod Rheumatol. 2017; 27: 130-6
[利益相反]本試験は大正製薬株式会社の支援によって行われました。
本論文の著者には、大正製薬株式会社の社員が含まれます。
第Ⅲ相臨床試験(フルルビプロフェンパップとの比較試験[検証試験])
歩行時の膝の痛みに対する鎮痛効果[その他の評価項目]
ロコアテープ群はフルルビプロフェンパップ群に比べて貼付1週後、2週後、終了時におけるVAS変化量の改善を示しました。
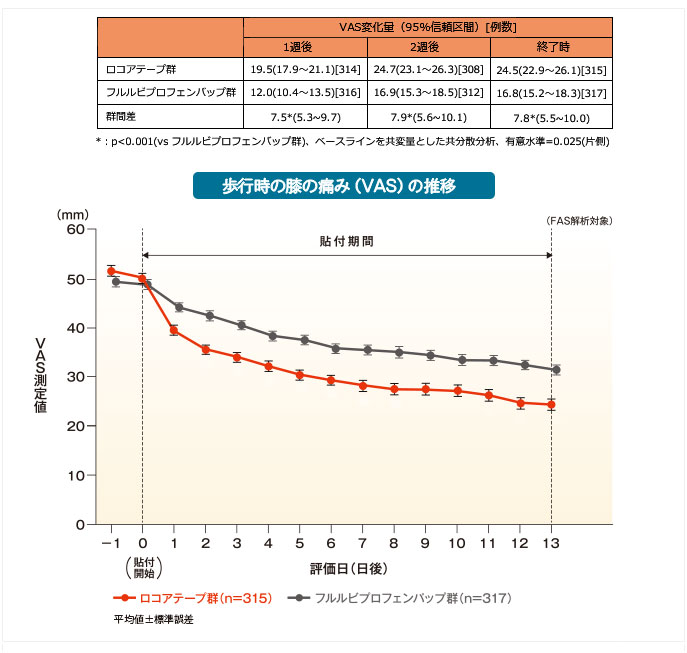
【VAS(歩行時の膝の痛み)の評価・測定方法】毎日、歩行時の膝の痛みを、患者がVASで評価した。欠測値について、各評価時期は集計から除外、 終了時はLOCF(Last Observation Carried Forward)法を用いて入力した。
承認時評価資料(変形性膝関節症患者を対象とした第Ⅲ相試験)
Yataba I et al. Mod Rheumatol. 2017; 27: 130-6
[利益相反]本試験は大正製薬株式会社の支援によって行われました。
本論文の著者には、大正製薬株式会社の社員が含まれます。
安全性
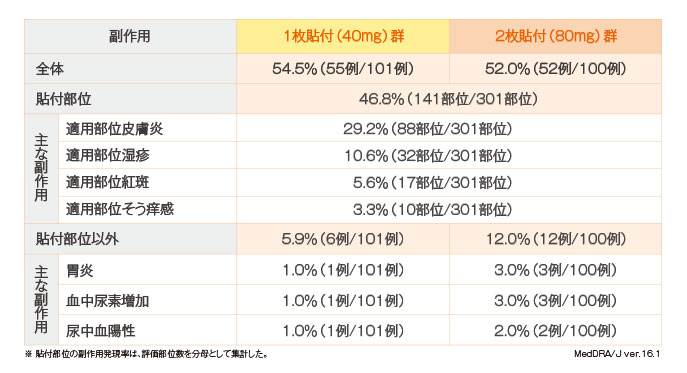
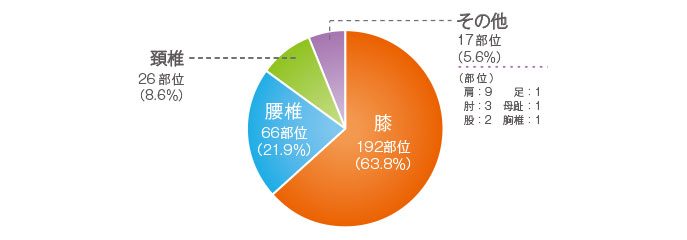
ロコアテープ群の副作用発現率は13.0%(41例/316例)で、貼付部位が9.5%(30例/316例)、貼付部位以外が4.4%(14例/316例)であった。フルルビプロフェンパップ群の副作用発現率は3.8%(12例/317例)で、貼付部位が1.6%(5例/317例)、貼付部位以外が2.2%(7例/317例)であった。
ロコアテープ群の主な副作用は、貼付部位では適用部位皮膚炎3.5%(11例/316例)、適用部位湿疹1.9%(6例/316例)、適用部位紅斑および適用部位そう痒感各1.6%(5例/316例)、貼付部位以外では血中尿素増加1.6%(5例/316例)、血中クレアチニン増加1.3%(4例/316例)が認められた。フルルビプロフェンパップ群では、貼付部位では適用部位皮膚炎0.6%(2例/317例)、貼付部位以外ではALT(GPT)増加、AST(GOT)増加各0.6%(2例/317例)などが認められた。
重篤な副作用として、ロコアテープ群に回転性めまい1例(貼付中止)が認められた。重篤な副作用以外で貼付中止に至った副作用は、ロコアテープ群では適用部位皮膚炎3例、発疹1例、フルルビプロフェンパップ群では適用部位皮膚炎1例であった。
第Ⅲ相臨床試験(フルルビプロフェンパップとの比較試験[検証試験])
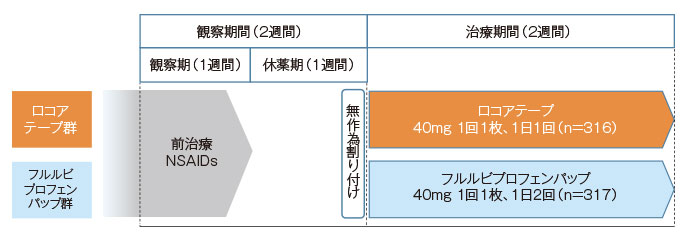
デザイン
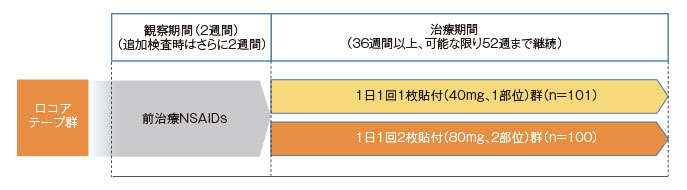
多施設共同無作為化並行群間比較試験(医師・患者は盲検、治験協力者は非盲検)
目的
変形性膝関節症患者に対し、ロコアテープまたはフルルビプロフェンパップを2週間貼付し、有効性(フルルビプロフェンパップに対する優越性)を検証するとともに、安全性を検討する。
対象
変形性膝関節症患者633例
主な選択基準:●片膝優位に疼痛症状あり(非評価膝の疼痛症状が軽度またはなし)
●X線所見でKL分類のⅡ∼Ⅲ度に該当
●膝の手術歴、他の膝痛疾患の合併なし
方法
ロコアテープ群またはフルルビプロフェンパップ群に無作為に割り付け、ロコアテープ群は1回1枚(40mg)を1日1回、フルルビプロフェンパップ群は1回1枚(40mg)を1日2回、評価膝に2週間反復貼付した。
評価項目
- ●主要評価項目:VAS*による疼痛評価(起立時の膝の痛み)
- ●副次評価項目:臨床症状推移、全般改善度
- ●その他の評価項目:患者の印象、VAS*による疼痛評価(歩行時の膝の痛み)
- ●安全性評価項目:有害事象・副作用、臨床検査値・理学検査値
*VAS:Visual Analogue Scale
解析計画
[主要評価項目]VAS(起立時の膝の痛み)は、貼付開始時、1週後、2週後、および中止時に測定し、各測定値および変化量について用量群別に基本統計量を算出した。終了時(貼付2週後または中止時)における変化量はベースラインを共変量とした共分散分析を適用して群間比較を行い、95%信頼区間および群間差の95%信頼区間を算出した。
[副次評価項目]臨床症状推移(合計)について、貼付開始時、1週後、2週後、および中止時に測定し、主要評価項目と同様の集計・解析を行った。全般改善度について、2週後、または中止時に測定し、用量群別に頻度集計を行った。また、2標本Wilcoxon検定を適用して群間比較を行った。
[その他の評価項目]患者の印象について、2週後、または中止時に測定し、副次評価項目の全般改善度と同様の集計・解析を行った。VAS(歩行時の膝の痛み)について、毎日測定し、主要評価項目と同様の集計・解析を行った。有意水準は、有効性に関する検定では2.5%(片側)とした(特に定める場合を除く)。